Ⅱ.血液細胞形態診断の極意
- 骨髄塗抹標本の血液細胞形態は、造血器腫瘍の発症時において、疾患の診断、病型あるいは病期に関する情報を提供する。
- 正確な血液細胞の形態診断は、骨髄吸引液の塗抹標本の質に依存しており、末梢血混入を回避するよう吸引採取し、適切に標本を作製する。
- 骨髄検査の解釈には、末梢血混入の影響の有無を評価することが極めて重要で、その指標として、脂肪滴、顆粒球系と赤芽球系の比、顆粒球系の分化成熟段階、血小板数と巨核球の乖離、リンパ球の比率に着目する。
- 骨髄塗抹標本の血液細胞形態は、治療効果、背景疾患、造血状態や治療合併症に関する情報を提供する。
- 急性骨髄性白血病の形態に基づく診断において、標準化された細胞判定および精度管理された細胞分類が重要で、異常幼若細胞(芽球、前骨髄球、異常前単球)の判定と細胞異形成の定量的評価を精確に行う。
- 形態所見に基づく病型診断において、染色体・遺伝子異常に基づく特徴的な細胞所見に着目する。
- 病型の確定は、形態診断とともに、基礎疾患や治療経過などを踏まえて、細胞表面マーカー検査、染色体・遺伝子検査の所見を総合し診断アルゴリズムに従って行う。
1.骨髄塗抹標本の作製と観察の基本
(1)骨髄検査の検体採取、保存、塗抹標本の作製
骨髄検体の採取部位は通常、骨髄腔にアクセスするための広い面積をもち、より安全に採取実施が可能な後上腸骨陵にて行う。穿刺吸引時には、骨髄腔内に発達した静脈洞からの末梢血の混入を回避することが大切である。骨髄吸引液は、針を穿刺後、一気の陰圧による素早い吸引で0.2-0.5mLを採取する。末梢血の混入した検体では、芽球など異常な細胞の比率が相対的に低下し、急性白血病の診断や病型分類に影響が出る。また、巨核球やマクロファージなど骨髄中にのみ存在する細胞成分での形態異常、骨髄浸潤性病変について検出や評価が困難となる。
骨髄吸引液の塗抹標本の作製は、ベッドサイドにて吸引採取時に抗凝固剤を用いず、速やかに行う。吸引した骨髄液は、通常は引きガラス(ヘマトサイトメータ用カバーガラス)を用いて直接塗抹にてスライド標本を作製する(ウエッジ法)。骨髄吸引液の塗抹標本作製は、有核細胞数が多いこと、粘稠度が高いことから、末梢血の場合より薄く塗抹する。塗抹後、ドライヤーなどの冷風にて強制乾燥する。塗抹標本数は、普通染色と特殊染色用に、10枚程度を作製する。塗抹標本は長期間保存すると、普通染色で青く染色され、細胞分類が困難となる。特殊染色の内、酵素染色は酵素が時間とともに活性低下するため、塗抹後早期に固定・染色する。なお、骨髄検体採取時に染色体検査や細胞表面マーカー検査(フローサイトメトリー法)用の検体を採取する場合、抗凝固剤として用いるヘパリンが塗抹標本に混入すると細胞が変性し細胞形態検査に適さない。
骨髄有核細胞数、巨核球数は、吸引した骨髄液をチュルク液で希釈し、計算板で算定する。チュルク液を一定量試験管に分注しておき、骨髄液をマイクロピペットにて加え、希釈・染色する(それぞれ1mL、20μLであれば、希釈率は50倍)。
病理組織検査が必要な場合、骨髄穿刺吸引の前に骨髄組織生検を行うことが望ましい。骨髄生検の実施は、異常細胞の著しい増生や線維化などでdry tapとなり骨髄吸引液が得られない場合にも適応がある。小児では骨髄組織生検の実施が困難なことが多いため、吸引骨髄液からの骨髄組織小片をスライド同士で押しつぶし伸展するスライド標本(圧挫伸展標本)や残存骨髄液の凝集後に固定液に浸ける骨髄クロット標本も作製しておく。細胞密度の正確な評価やがん細胞の骨髄浸潤の検出に利用する。
(2)判定と結果の解釈
1)塗抹標本の観察のポイント
- 1目視観察では、骨髄液が適切に吸引採取された指標として、骨髄組織小片(パーティクル)や脂肪滴を確認する。
- 2弱拡大(100倍)では、適切な標本であるか、有核細胞密度や脂肪細胞の程度を指標として確認し、巨核球数の増減や形態を評価する。次に、腫瘍細胞の集塊の有無を調べる。異常細胞は、骨髄標本の引き終わりや辺縁に大型細胞として集簇していることが多い。
- 3中拡大(200-400倍)にて、各造血細胞系統の比率あるいは分化成熟の状態を評価する。
- 4強拡大(1000倍)にて、500-1,000個の細胞分類を行い、異常細胞の詳細な形態観察を行う。異常細胞の鑑別は、細胞の大きさ、細胞質、顆粒、核形、クロマチン構造、核小体などに基づき行う。
2)データの解釈
- 1正確な形態診断は、骨髄吸引液の塗抹標本の質に依存している。骨髄検査の解釈において、末梢血混入の影響の有無の指標として、骨髄パーティクル、脂肪滴、顆粒球系と赤芽球系の比、顆粒球系の分化成熟段階、血小板数と巨核球の乖離、リンパ球比率に着目する。
- ア同時に行った有核細胞数(基準範囲 10-25万/μL)あるいは巨核球数(基準範囲50-150/μL)の算定においては、末梢血混入の場合、希釈されて低値となる。有核細胞密度あるいは巨核球数の増減は、細胞密度と矛盾がないかを確認する。顆粒球系細胞や赤芽球系細胞では、各分化成熟段階(それぞれ後骨髄球、多染性赤芽球が中心)の細胞が整っているかを確認する。末梢血が混入した場合、末梢血中からの白血球の混入のため、顆粒系成熟細胞の比率が高くなる。
- イ顆粒球系と赤芽球系細胞の比率(ME比、基準範囲2:1-3:1)から、それぞれの細胞増殖の相対的な程度を知る。
- ウ単球、リンパ球、形質細胞、マクロファージの比率、形態変化を確認する。
- エ細胞異形成が見られる場合、細胞系統ごとの異形成所見の定量的評価を行う(後述)。
- 2急性白血病と骨髄の形態変化の関係を図1に示す。初発時の骨髄検査においては、形態変化の由来は、腫瘍性細胞と宿主細胞に大別される。前者には、芽球増加に加え、その背景疾患となる骨髄異形成症候群(myelodysplastic syndromes:MDS)や骨髄増殖性腫瘍(myeloproliferative neoplasms:MPN)に伴う形態変化がある。後者では、正常造血が抑制されることによる成熟段階の血液細胞の減少および間質細胞(脂肪細胞、内皮細胞など)の変化(マクロファージ活性化、線維化など)が見られる。
- 3異常細胞として、芽球(増加)に加え、リンパ腫細胞やがん細胞などの鑑別が必要となる。
- ア急性白血病の診断の課題として、正常B前駆細胞に由来する小型の芽球細胞であるヘマトゴンhematogoneがある。ヘマトゴンhematogoneは、小児での抗がん剤化学療法後、骨髄移植後など骨髄回復期や各種非造血器疾患において、正常B前駆細胞に由来する小型の芽球細胞である。悪性リンパ腫や固形腫瘍の骨髄浸潤や急性白血病の診断において、形態学的な芽球の判定は重要となる。血球減少をともなう初診患者では、Bリンパ芽球性白血病との鑑別を要し、Bリンパ芽球性白血病の患者では治療後の残存病変や再発の評価において診断上の課題となる。形態的には小型の細胞で細胞質に乏しい。核形は円形で、核網は均一で濃厚、核小体は不鮮明である。細胞表面形質ではCD10、19陽性細胞で、多クローン性成熟B細胞である。
- イ小児の悪性リンパ腫は、病型としてBリンパ芽球性リンパ腫 B lymphoblastic lymphoma (B-LBL)、Tリンパ芽球性リンパ腫 T lymphoblastic lymphoma (T-LBL)、バーキットリンパ腫:Burkitt lymphoma、未分化大細胞型リンパ腫:anaplastic large cell lymphoma (ALCL) (Ki-1 lymphoma)が大半を占める。これら病型の多く、特にB-LBL、T-LBL、バーキットリンパ腫では骨髄浸潤をきたしやすく(stage IV)、骨髄中の芽球細胞が25%を超えるときは急性リンパ性白血病と診断される。
- ウ小児の固形腫瘍では、上記の悪性リンパ腫をはじめ、神経芽腫、横紋筋肉腫、ユーイング肉腫ファミリー腫瘍など、細胞サイズが小さく、small round cell tumorと呼ばれる。これらは骨髄浸潤しやすく、ときに白血病との鑑別を要する。
2.形態診断の進め方のポイント
(1)骨髄系幼若細胞の同定と細胞分類
急性骨髄性白血病(acute myeloid leukemia:AML)のWHO分類では、骨髄有核細胞(末梢血白血球)中の芽球比率が20%以上に増加している場合を急性白血病とする。ただし、芽球比率20%未満でも、その他の検査所見に基づく基準を満たした場合はAMLとする(表1)。続いて病型診断は、各細胞系統の分画、芽球の特殊染色、細胞表面マーカーの性状および染色体・遺伝子検査の所見を併せて行う(図2.詳細は前章「Ⅰ.WHO分類に基づいたAML診断の進め方」を参照)。
芽球比率では、顆粒有り芽球(タイプII)と前骨髄球の鑑別が重要である。異常幼若細胞(芽球、前骨髄球)の判別は、病型診断として未分化型AML(M1)、分化型AML(M2)および急性前骨髄球性白血病(acute promyelocytic leukemia:APL,M3)の病型診断を左右する。顆粒あり芽球(タイプII)と前骨髄球の判別のポイントは、前者の形態は、顆粒なし芽球に細胞質顆粒が加わった細胞である(図3A)。ただし、症例(病型)によって、顆粒なし芽球の形態は大きく異なるため、主体となる芽球の特徴をとらえ、それを基準に判別を行う。これらの点に留意して形態所見を観察すれば、骨髄で増殖した異常幼若細胞の主体が芽球(タイプII)であるか、前骨髄球であるか容易に判別でき、病型が正しく判断できる。
また、WHO分類では、前単球は芽球相当として取り扱う。このため、その細胞判定と分類が重要となる。単芽球は、大きなサイズで僅かな顆粒を含む比較的豊富な細胞質をもち、核は円形でレース様の核網と1〜2個の明瞭な核小体が見られる。前単球は、核形がより不規則で折り重なっており、繊細なクロマチン構造と小さな不明瞭な核小体が見られる(図3B)。その細胞カウントは、急性単芽球性・単球性白血病、急性骨髄単球性白血病および慢性骨髄単球性白血病(芽球相当を含む芽球比率<20%)の病型診断を左右する。
古典的な15;17転座のAPLの診断には、アウエル小体やファゴット細胞の所見確認が必要である。これらが明らかでない場合、15;17転座以外のRARA再構成を有するバリアント転座APLの鑑別が必要となる。鑑別の指標として、前者に特徴的な微細な顆粒、核の切れ込みやファゴット細胞、後者に特徴的な濃い顆粒や核形整な前骨髄球を確認する。
(2)急性骨髄性白血病の基本的な病型分類
細胞分類に続いて、基本的な病型分類を行う(図4)。WHO病型分類の他のカテゴリーに該当しないAML(AML, not otherwise specified)は、FAB病型分類を踏襲している。そこで、ミエロペロキシダーゼ(MPO)陰性(3%未満)の場合、免疫形質、染色体検査やキメラ遺伝子検査の結果が不明の段階では、形態診断による病型分類は実際上の課題となる。MPO陰性AMLの病型としては、最未分化型急性骨髄性白血病、急性単芽球性白血病、急性赤白血病あるいは急性巨核芽球性白血病が挙げられ、その鑑別はしばしば困難である。以下に、急性単芽球性白血病と急性巨核芽球性白血病の形態診断のポイントを挙げる。
急性単芽球性白血病の多くは非特異的エステラーゼ染色陽性にて確認できる。しかしながら、10-20%の症例で非特異的エステラーゼ染色陰性(または弱陽性)であり、細胞表面マーカーでも単球系抗原の発現が明らかでない。このため普通染色標本での形態所見(レース様の核網、明瞭な1〜2個の核小体、透明感のない豊富な青灰色の細胞質)が最終的な決め手となる。
急性巨核芽球性白血病では分化度から2つのタイプに大別される(図5)。未分化なタイプでは、芽球がおおむね中型、細胞質好塩基性で、N/C比大きく核網繊細である。分化傾向のあるタイプでは、異常細胞の多様性が特徴的である。細胞の分化度の異なる大小不同の細胞から構成される。細胞質にしばしば突起を認める。核の性状は、核網が均一でやや硬いもの、多核の芽球から微小巨核球まで多彩である(症例参照)。末梢血中での微小巨核球や巨核芽球断片、異形成が強い血小板の出現の所見は、急性巨核芽球性白血病の病型診断の参考となる。MPO陰性のAMLの病型鑑別は、形態的な所見のみでは限界があり、細胞表面マーカーなど他の検査所見を総合して確定する。
(3)細胞異形成の定量的評価
末梢血または骨髄の芽球と細胞異形成の割合は、急性白血病(原発性、二次性)の診断に加え、AMLや骨髄異形成症候群の病型診断の基準に利用される。
多系統の細胞異形成を伴うAML(AML with multilineage dysplasia)は、2系統以上の細胞異形成(各系統50%以上)で予後不良因子とされる。WHO分類2017年版では、骨髄異形成関連変化を伴うAML(AML with myelodysplasia-related changes:MRC)の病型が設置されており、診断基準として、①多系統の細胞異形成、②骨髄異形成症候群または骨髄異形成/骨髄増殖性腫瘍の既往、③関連する染色体異常の何れかがあれば本病型に診断される。
細胞異形成が見られる場合、細胞系統ごとの異形成所見の定量的評価を行う(図6)。細胞異形成とは、顆粒球系における低顆粒性細胞質、低分節核(偽ペルゲル核)、異常分節核、赤芽球系における巨赤芽球様変化、核融解、核形態の不規則性・細分化、多核、環状鉄芽球、PAS陽性、巨核球系における微小巨核球、単核・円形分離多核等である。骨髄中の芽球増生が著しいために、巨核球系や成熟顆粒系が減少し、その観察が難しい場合、末梢血での好中球(細胞質顆粒減少、偽ペルゲル核)や血小板(巨大血小板、顆粒減少)の異形成所見が参考になる。
(4)反復性の染色体・遺伝子異常に特徴的な形態所見
WHO分類2017年版では、予後良好なt(8;21)(q22;q22.1);RUNX1(AML1)-RUNX1T1(ETO) 、inv(16)(p13.1q22) or t(16;16)(p13.1;q22);CBFB-MYH11、t(15;17)(q22;q12); PML-RARAに加え、APLで非典型的な染色体異常が別に取り扱われ、また予後不良な3病型t(6;9)(p23;q34.1);DEK-NUP214(CAN)、inv(3)(q21.3q26.2) or t(3;3)(q21.3;q26.2);GATA2,MECOM(EVI1)、t(1;22)(p13.3;q13.1);RBM15(OTT)-MKL1(MAL)が追加されている。
AML病型特異的な染色体・遺伝子異常(recurrent cytogenetic abnormalities)では、主な染色体・遺伝子異常において、特徴的な形態所見があり、その総合的な評価によって染色体・遺伝子異常を推定可能な場合が多い。一例として、t(8;21)(q22;q22.1);RUNX1(AML1)-RUNX1T1(ETO) をともなうAMLでは、分化傾向を有する大型の芽球、両端が細く尖った1本のアウエル小体、サーモンピンク色の好中球、好中球偽ペルゲル核異常などが特徴的である(症例参照)。
骨髄の好酸球の形態は、分化傾向をもつAMLの病型診断の参考となる(症例参照)。inv(16)(p13.1q22) or t(16;16)(p13.1;q22):CBFB-MYH11をともなうAMLでは、幼若な好酸性顆粒、すなわちバイオレット紫の粗大な顆粒が認められる。なお、幼若な好酸性顆粒は症例によって出現頻度が異なるため、形態観察において注意する。t(8;21)(q22;q22.1);RUNX1(AML1)-RUNX1T1(ETO) をともなうAMLでは、正常な好酸球の増加を来す。t(6;9)(p23;q34.1);DEK-NUP214(CAN)をともなうAMLは、成熟を伴うAML(M2)または急性骨髄単球性白血病(M4)を呈し、好酸球に暗く染まる顆粒をもつことを特徴とする(図7)。前2者の染色体異常は予後良好であるのに対して、後者は予後不良である。
骨髄塗抹標本の血液細胞形態では、異常細胞増殖とともに、背景疾患(骨髄異形成症候群や骨髄増殖性腫瘍など先行疾患、潜在クローン)、造血状態、治療合併症に関する情報が得られる。治療抵抗性の潜在クローンを示唆する所見として、t(8;21)(q22;q22.1)における造血器腫瘍に関連した全身性肥満細胞症Systemic mastocytosis with an associated haematological neoplasm (SM-AHN) の診断のため、肥満細胞の集族に留意する(症例参照)。
おわりに
医療技術の進歩と普及にともない、白血病をはじめとする造血器腫瘍の患者診療における検査血液学の重要性が増大している。治療面では、分子標的療法をはじめ疾患や病型に有効な新規治療法の開発と導入により、層別化さらに個別化医療が推進されている。そこで病型診断や病期分類は、血液細胞分類や形態所見の精度管理を踏まえた上で、診断アルゴリズムに基づき、標準化された診断が求められる。初発時の形態診断は一般に、免疫形質、染色体検査やキメラ遺伝子検査の結果が不明の段階であり、形態所見のみでは最終的な病型診断は困難である。一方、従来からの形態所見に基づくFAB分類あるいは形態所見を踏まえたWHO分類は、簡易で迅速な情報として従来以上に重要となっている。各施設における標準化された細胞判定の導入と精度高い細胞分類に基づく正しい病型診断の実施により、造血器腫瘍の個別患者の診断と治療、さらにはエビデンス作成に基づく良質な患者診療に寄与することが望まれる。
- 1土屋達行、渡邊眞一郎.骨髄像の観察. スタンダード検査血液学、医歯薬出版株式会社、東京、2021、p151-160.
- 2Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood. 2016;127:2391-405.
- 3Campo E, Swerdlow SH, Harris NL,et al.The 2008 WHO classification of lymphoid neoplasms and beyond: evolving concepts and practical applications. Blood. 2011; 117: 5019–5032.
- 4宮地勇人.血液細胞形態診断.堀部敬三編.小児がん診療ハンドブック.医薬ジャーナル社.大阪.p66-74. 2011.
- 5宮地勇人.造血器疾患の診断精度向上に向けた検査情報連携.臨床検査2014; 58: 427-435.
- 6宮地勇人.急性白血病を正しく診断するためのポイント.臨床検査2015; 59: 697-703.
図の説明
図1.急性白血病と骨髄の形態変化の関係(文献4より引用)
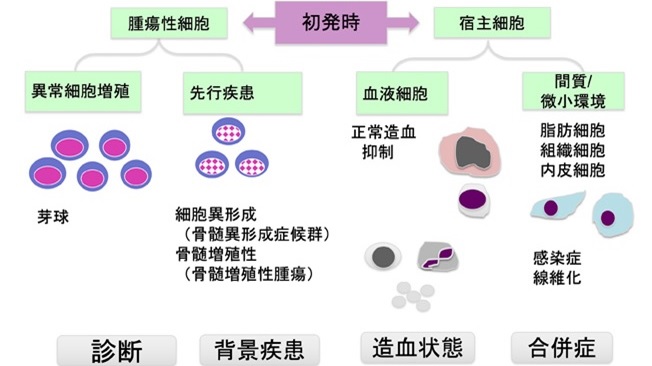
図2.WHO分類に基づく急性骨髄性白血病の診断プロセス(文献5より引用)
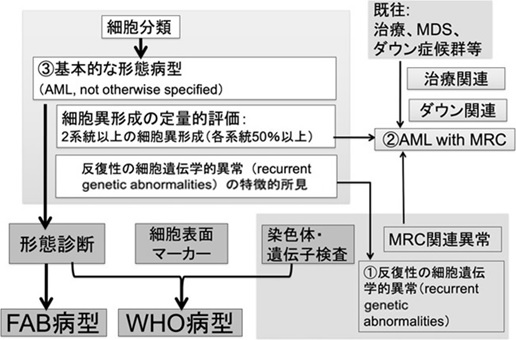
図3.病型分類を左右する細胞判定(文献6より引用)
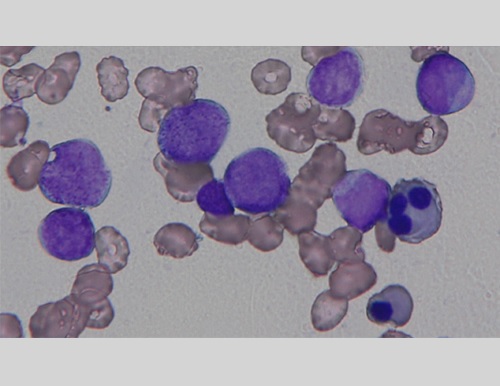
骨髄芽球は、中型から大型のサイズで、細胞質は濃い青色から青灰色、核形は円形から卵形で、繊細顆粒状の核クロマチン構造といくつかの核小体を有する。骨髄芽球には、顆粒なし芽球(タイプI)と顆粒あり芽球(タイプII)がある。図の細胞の多くは、後者である。前骨髄球と細胞判定した場合、異なる病型分類となりうる。偽ペルゲル核異常や好中球の低顆粒がみられる。単球系細胞にも若干の異形成を認める。
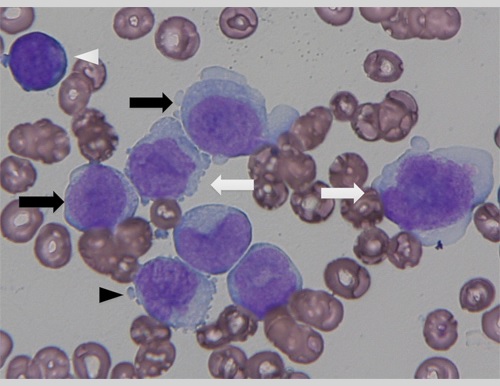
単芽球は、大きなサイズで僅かな顆粒を含む比較的豊富な細胞質をもち、核は円形でレース様のクロマチン構造と1〜2個の明瞭な核小体が見られる(黒矢印)。異常前単球は、より不規則で折り重なった核形を示し、繊細なクロマチン構造と小さく不明瞭な核小体が見られる(白矢印)。異常単球は、入り込むまたは折り重なる核形と濃縮した核クロマチンを呈し、細胞質はより多くの顆粒をもつ(黒矢頭)。骨髄芽球も認められる(白矢頭)。
図4.形態所見による基本的なWHO病型分類のプロセス

図5.MPO陰性AMLの病型鑑別:急性巨核芽球性白血病(文献6より引用)
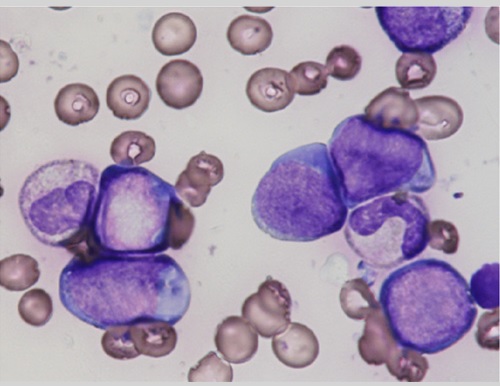
芽球はおおむね中型で細胞質好塩基性、N/C比高く核形は類円形、核網繊細である。
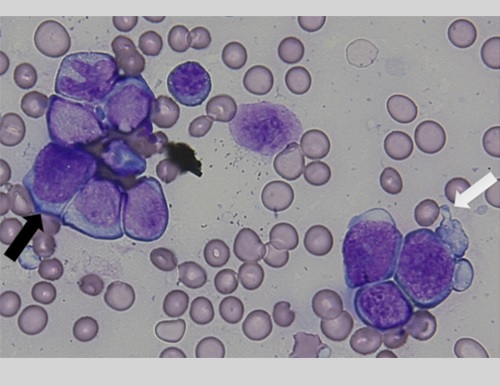
異常細胞は、多形性が特徴的である。細胞のサイズは中型から大型で、核の性状は、核網が均一でやや硬いもの(黒矢印)、多核の芽球から微小巨核球まで多彩である。細胞質にはしばしば突起(またはブレブ)を認める(白矢印)。
図6.細胞異形成所見(文献6より引用)
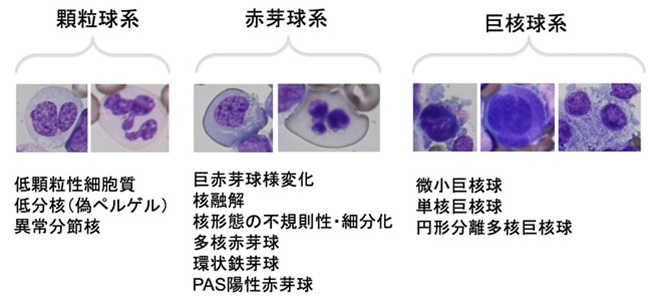
図7.骨髄好酸球の細胞形態による病型鑑別(骨髄塗抹標本の普通染色メイ・グリュンワルド・ギムザ染色所見)(文献5より引用)
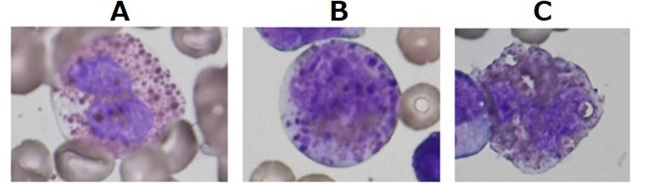
A:t(8;21)(q22;q22.1);RUNX1(AML1)-RUNX1T1(ETO) をともなう急性骨髄性白血病(acute myeloid leukemia: AML)では正常な好酸球の増加を呈する。
B:inv(16)(p13.1q22) or t(16;16)(p13.1;q22):CBFB-MYH11をともなうAMLでは、骨髄の好酸球増加を認め、多くは幼若な好酸性顆粒、すなわちバイオレット紫の粗大な顆粒をもつ。粗大で特徴的な色調から異常な好酸球と判断できる。
C:t(6;9)(p23;q34.1);DEK-NUP214(CAN)をともなうAMLは、成熟を伴うAML(M2)または急性骨髄単球性白血病(M4)の病型を示し、好酸球に暗く染まる顆粒をもつことを特徴とする。
| AMLの病型 | 診断所見 | |
|---|---|---|
| 1 | t(8;21)(q22;q22.1);RUNX1(AML1)-RUNX1T1(ETO)をともなうAML | 染色体・遺伝子異常 |
| inv(16)(p13.1q22) or t(16;16)(p13.1;q22):CBFB-MYH11をともなうAML | ||
| t(15;17)(q22;q12);PML-RARAをともなうAML | ||
| 2 | 急性単芽球・単球性白血病、急性骨髄単球性白血病 | 異常前単球→芽球相当 |
| 3 | 赤白血病(Pure erythroid leukemia) | 赤芽球≧80% かつ 前赤芽球≧30% |
| 4 | 急性巨核芽球性白血病 | 組織検査にて芽球集簇 |
- 宮地 勇人
- 新渡戸文化短期大学 学長
本症例集で取り上げた症例の中央診断においては下記の方々(敬称略)のご指導・ご尽力をいただきました。厚く御礼申し上げます。
多和昭雄、足立壯一、多賀崇、林泰秀、高橋浩之、松下弘道、清河信敬、出口隆生、照井君典、橋井佳子、太田秀明、鶴澤正仁、駒田美弘、横澤敏也、堀部敬三、伊藤雅文(日本小児がん研究グループ 血液腫瘍分科会)
矢部みはる、蟹由公子(東海大学医学部基盤診療学系臨床検査学)
田中由美子(東海大学医学部付属病院)
- ※Copyright 2021 株式会社 ビー・エム・エル All rights reserved.
このページ表示されているすべての情報(画像、図、表、文章等)の無断転載を禁じます。